Kanker en ketogeen eten
Geef kanker geen kans!
Kanker is een verschrikkelijke ziekte die sinds de jaren 70 steeds meer voorkomt. In 2022 werden alleen al in Nederland ongeveer 124.100 nieuwe gevallen van kanker vastgesteld. Er zijn meerdere therapieën om te vechten tegen deze ziekte, waarvan chemotherapie, bestraling en operatieve verwijdering de meest bekende zijn. Maar er is echt zo veel meer mogelijk. In dit artikel ga ik je alles uitleggen over kanker, niet alleen wat het precies is, maar ook hoe kankercellen werken. En nog belangrijker, hoe je met voeding een gigantisch krachtig strijdwapen kunt creëren, waardoor kanker vrijwel geen kans meer maakt.
Wat is kanker?
Kanker ontstaat in gewone normale cellen, die niet meer in staat zijn om goed te functioneren (beschadigde cellen). Een volwassen mens van 75 kg bestaat uit ongeveer 60 biljoen cellen, waarbij iedere aanwezige cel de potentie heeft om uit te kunnen groeien tot een kankercel. Elke seconde gaan er een miljoen cellen dood in ons lichaam. Dat komt neer op ongeveer een kilogram aan dode cellen per dag. Ons lichaam ontdoet zich van deze cellen omdat ze oud, beschadigd of gemuteerd zijn. De cellen die niet meer bruikbaar zijn worden in een normale situatie afgebroken en vervangen door nieuwe cellen. Kankercellen ontstaan als een gewone cel zichzelf niet vernietigt. Deze cel blijft in dat geval doorgroeien, waarbij de cel dusdanig verandert en dat deze kost wat het kost zal blijven overleven. Omdat de cel niet meer goed functioneert zoals een normale cel dat doet, geeft dit problemen. Omdat de cel niet afsterft worden deze probleem veroorzakende cellen alleen maar groter en groter.
Hoe werkt een normale cel?
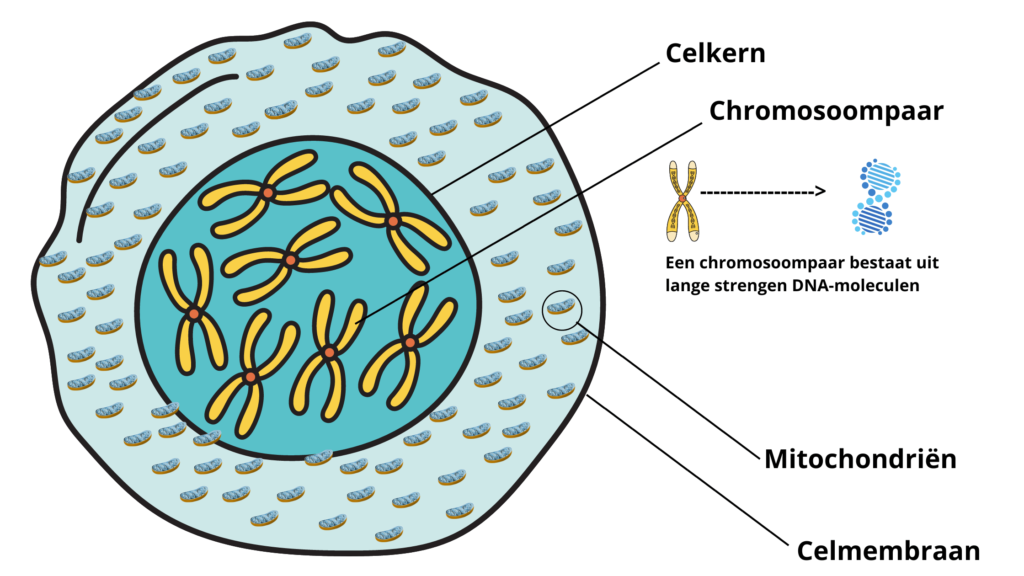
Een normale gezonde cel is opgebouwd uit meerdere lagen. Van binnen naar buiten toe; allereerst heb je de celkern, in de celkern zitten 23 chromosoomparen (chromosoomparen bestaan uit lange strengen die zijn opgebouwd uit DNA-moleculen waarbij een bepaald stuk van de streng een gen genoemd wordt). Vervolgens heb je de mitochondriën, gevolgd door het celmembraan.
Mitochondriën
De mitochondriën spelen een hele belangrijke rol bij het ontstaan en de verdere ontwikkeling van kankercellen. Zij zijn namelijk een van de belangrijkste onderdelen van onze cellen (en dus van ons lichaam, aangezien ons lichaam bestaat uit cellen). Mitochondriën beschikken namelijk (buiten de celkern) ook over hun eigen specifieke DNA, waardoor ze een verregaande vorm van “zelfbestuur” hebben.
Mitochondriën kun je zien als de energiecentrale van onze cellen. Doordat mitochondriën hun eigen DNA hebben, zijn zij in staat om zich te kunnen delen, waardoor de mitochondriën hun aantal kunnen aanpassen naar de energiebehoefte van de betreffende cel. Doordat zij dat kunnen kan er in ons lichaam bepaalt worden hoeveel energie bijvoorbeeld een specifieke spier nodig heeft. Een gemiddelde lichaamscel heeft zo rond de 400-500 mitochondriën, maar hartcellen kunnen er zelfs tot wel 1000 stuks bevatten (omdat deze meer energie nodig hebben). Het DNA in de mitochondriën is echter, in tegenstelling tot het DNA in onze celkernen, onbeschermd, hierdoor is het erg kwetsbaar en veel gevoeliger voor beschadigingen. De mitochondriën zijn extra kwetsbaar, doordat er met behulp van zuurstof energie wordt opgewekt, waardoor er zogenaamde vrije zuurstofradicalen vrijkomen die het onbeschermde mitochondriale DNA kunnen beschadigen. En juist de beschadigingen in de mitochondriën, dat is wat een grote rol speelt in het ontstaan en de ontwikkeling van kankercellen. De mitochondriën zijn er namelijk verantwoordelijk voor dat een cel afsterft (ook wel apoptose genoemd, wat zelfdoding van een cel betekent) als deze beschadigd is. Als de mitochondriën hun taak van het laten afsterven niet goed meer kunnen uitvoeren, blijft de cel doorgroeien en kan er een kankercel ontstaan. Kankercellen hebben altijd zwaar beschadigde mitochondriën.
De behandeling van kanker
De meest gebruikelijke behandelingen van kanker bestaan uit chemotherapie en bestraling. Deze behandelingen moeten ervoor zorgen dat de kankercellen vernietigd worden. Dit werkt in veel gevallen ook goed. Wat echter het grote nadeel is, is dat deze behandelingen ook schade aan ons lichaam aanbrengen. Maar ook dat dit symptoombestrijding is voor een probleem wat zich al in een vergevorderd stadium bevindt. Tevens, als de oorzaak niet aangepakt wordt, komt de kanker in veel gevallen later weer terug. Niet alleen is de kans aanwezig dat er nieuwe kankercellen vormen, maar ook is de kans vrij groot dat deze kankercellen resistent (immuun) zijn geworden voor de eerdere behandeling. Dat is waarom het vaak voorkomt dat bij mensen waarbij de kanker terug komt, de kans groot is dat zij, meestal op een vrij korte termijn, overlijden. In dit artikel gaan we dieper in op de oorsprong van kanker en wat jij zelf kunt doen om de kans op het ontwikkelen van kanker zo klein mogelijk te maken.
Wat onze cellen gebruiken voor energie
Om goed uit te kunnen leggen over hoe onze voeding effect heeft op de groei en overleving van kankercellen zal ik eerst een toelichting geven over hoe onze cellen normaal gesproken aan energie komen met een koolhydraatrijk voedingspatroon. Waarbij we dus goed gaan kijken naar wat koolhydraten precies zijn en wat zij met ons lichaam doen.
Glucose
Glucose bestaat uit alle verschillende soorten suiker die er bestaan. Denk hierbij dus niet alleen aan reguliere witte suiker, maar ook aan honing, zetmeel, fructose (fruitsuiker), lactose, etc…
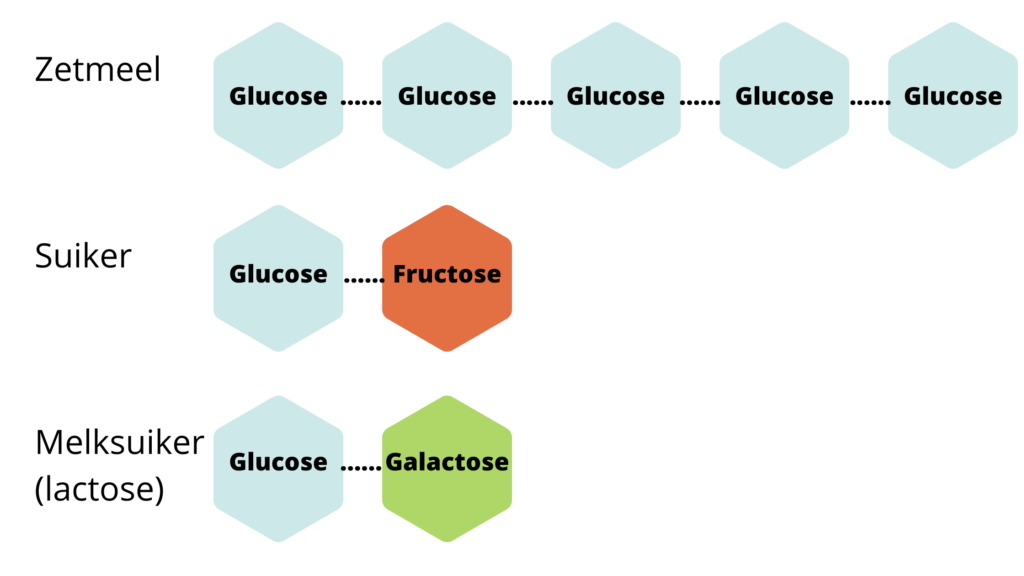
Zoals je bij de bovenstaande afbeelding kunt zien wordt zetmeel opgenomen als pure glucose. Suiker wordt opgenomen als glucose en fructose en melksuiker wordt opgenomen als glucose en galactose. Eenmaal opgenomen in ons bloed worden fructose en galactose in onze lever omgezet naar glucose en vetzuren. Onderstaand zie je dit uitgebeeld.
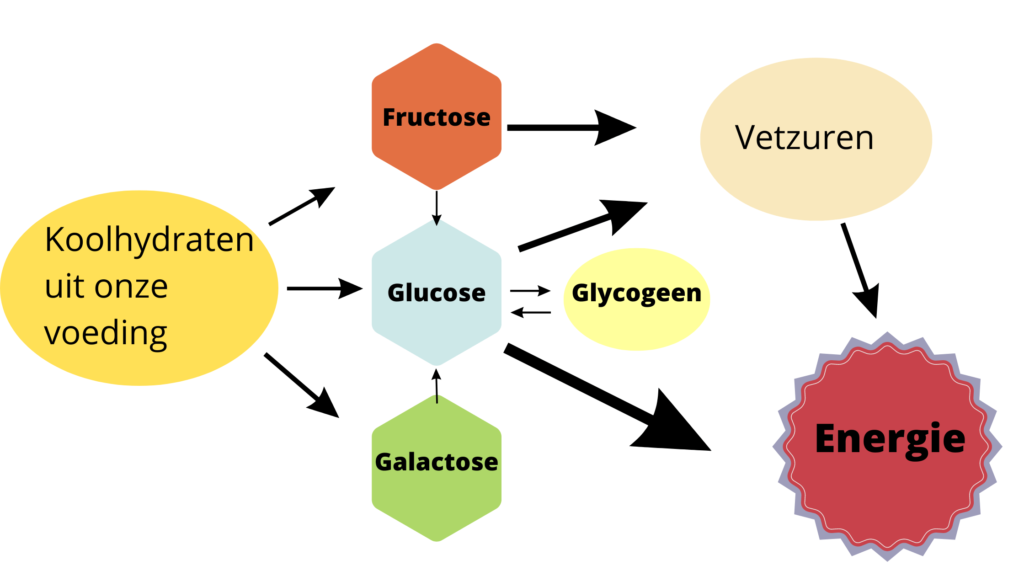
Glucose wordt direct gebruikt voor energie, waarbij de glucose die niet direct verbruikt kan worden wordt omgezet naar glycogeen, glycogeen wordt vervolgens in de lever en in de spieren opgeslagen. Het overige deel wat niet direct nodig is en niet in de lever en spieren opgeslagen wordt, dat wordt omgezet naar vetzuren die vervolgens als lichaamsvet worden opgeslagen. Wanneer de glucose en glycogeen op is (wanneer er dus geen overtollige suiker meer in het bloed aanwezig is) kan ons lichaam de vetzuren aanspreken als energiebron en kunnen deze, net zoals glucose, ook door de mitochondriën gebruikt worden als energie. Dat laatste staat ook wel bekend als ketose. Wat inhoudt dat je bloedsuiker (aanwezige glucose in het bloed) dermate laag is dat vetten worden aangesproken als brandstof.
Hoe glucose en vetzuren gebruikt worden als energie
De mitochondriën maken energie voor onze cellen, de glucose en vetzuren zijn namelijk niet in hun oorspronkelijke vorm bruikbaar om energie te leveren. Er is een chemische reactie nodig om de energie vrij te maken (ATP te vormen). De meest efficiënte manier daarvoor is dat de voedingsmiddelen reageren met zuurstof (de zuurstof die in ons lichaam aanwezig is). Bij deze reactie wordt er naast energie ook koolzuur en water gevormd, wat via de longen en nieren weer worden uitgescheiden. Energie wordt in de medische wereld ook wel ATP genoemd (ook wel bekend als Adenosinetrifosfaat), ATP is de drager van chemische energie in alle levende cellen. Het gevormde ATP kan vervolgens door de cellen worden gebruikt als energie. Dit proces kan alleen in de mitochondriën plaatsvinden.
De energie voor kankercellen met beschadigde mitochondriën
Een andere manier om ATP (energie) te creëren is door fermentatie. Maar, fermentatie kan alleen plaatsvinden met glucose (suiker), vetzuren en ketonen kunnen niet gefermenteerd worden. Fermentatie vindt alleen plaats als er gedurende een tijd geen zuurstof naar de cellen kan gaan, of als de mitochondriën beschadigd zijn en daardoor niet meer goed kunnen functioneren.
De nadelen voor ons lichaam van fermentatie voor energie
1. Fermentatie voor energie kan dus alleen plaatsvinden met glucose, maar om voldoende energie te kunnen vrijmaken moet er maar liefst 16 keer zo veel glucose (suiker) worden aangesproken. Dat wil zeggen dat er ontzettende hoeveelheden suiker nodig zijn om een kankercel voldoende energie te leveren.
2. Met fermentatie worden er geen koolzuur en water geproduceerd, maar wel grote hoeveelheden melkzuur. Het melkzuur wordt vervolgens door onze cellen naar buiten gevoerd, waardoor er verzuring optreedt in de ruimtes tussen onze cellen. Indien er chronische verzuring optreedt, is dat een signaal voor ons lichaam dat er niet voldoende zuurstof wordt toegevoerd. Het gevolg hiervan is dat er nieuwe, extra bloedvaten worden aangemaakt (ja zo knap is ons lichaam), richting de verzuurde delen van ons lichaam. Dat is een proces wat ook wel angiogenese wordt genoemd. Angiogenese speelt een grote rol bij de groei van kankercellen en bestaande tumoren.
3. Bij het proces van fermentatie worden er veel meer vrije zuurstofradicalen geproduceerd. Deze vrije zuurstofradicalen kunnen de mitochondriën verder beschadigen, op de langere termijn worden ook de overige onderdelen van onze cellen beschadigd door de vrije zuurstofradicalen en treden er steeds meer gen mutaties op in het DNA van de celkern. Tezamen met de ondertussen ook verstoorde apoptose (zelfdoding mogelijk van de cel door de mitochondriën) kan dit ertoe leiden dat de cel verder uitgroeit tot een kankercel.
4. Doordat een aangetaste cel genoodzaakt is om glucose als energiebron te gebruiken doormiddel van fermentatie, kan deze geen vetzuren en ketonen meer gebruiken voor energie, waardoor de cel volledig afhankelijk is van glucose.
Samengevat/conclusie
* Een gezonde cel kan glucose, vetzuren en ketonen met behulp van zuurstof omzetten naar bruikbare energie, waarbij er koolzuur en water worden geproduceerd en wordt afgevoerd door de lever en de nieren.
* Een kankercel kan alleen glucose omzetten naar energie doormiddel van fermentatie, wat een hoop melkzuur produceert en andere problemen daarmee veroorzaakt. Indien dit proces langdurig plaatsvind treedt er onvermijdelijk DNA beschadiging op.
Met andere woorden, een fermenterende cel stimuleert de groei van kankercellen en zorgt er tevens voor dat een al afwijkende cel nooit meer normaal kan worden en alleen maar verder beschadigt.
Nu zou je denken dat glucose (suiker) dus de enige energiebron is voor kankercellen. Maar er is (helaas) nog een andere bron van energie voor kankercellen, dat is namelijk glutamine. Glutamine is een natuurlijk voorkomend aminozuur, wat wij niet alleen door onze voeding binnen krijgen (in eiwitrijke voeding), maar wat ons lichaam ook zelf aanmaakt. Ook glutamine kan enkel doormiddel van fermentatie gebruikt worden door kankercellen, bovenstaand proces blijft daar dus ook voor gelden. Meer over glutamine wordt verderop in het artikel behandeld, onder de kop voedingsadvies.
De meest voorkomende kankerverwekker

Er zijn veel dingen om ons heen waarvan we allemaal weten dat deze kankerverwekkend zijn. Denk hierbij aan roken, asbest en de blootstelling aan schadelijke stralingen. Maar wat veel mensen niet weten is dat suiker de meest veelzijdige kankerverwekker is. Het is zelfs zo schadelijk voor ons, dat een glas frisdrank of vruchtensap waarschijnlijk net zo kankerverwekkend is als een sigaret opsteken! 100 ml frisdrank per dag leidt al tot een verhoging van het risico op kanker met maar liefst 18%, bizar toch?!
De toename van onze suikerconsumptie
Vroeger was suiker een echt luxe product, waardoor het voor veel huishoudens niet (of vrijwel niet) gebruikt werd. Sinds de 19e eeuw is dit echter volledig omgedraaid. Tegenwoordig is het zelfs zo erg dat er in bijna alle levensmiddelen die te koop zijn suiker te vinden is. Dit heeft meerdere redenen. Suiker is sinds de 19e eeuw erg goedkoop te produceren, om de eigenschappen die suiker heeft wordt hier veelvoudig gebruik van gemaakt. Suiker zorgt er namelijk voor dat producten langer houdbaar zijn, dat brood beter rijst (en dus luchtiger wordt), het versterkt sommige smaken (en verbloemd minder lekkere smaken), het werkt verslavend, waardoor mensen meer van bepaalde producten willen eten en tot slot vinden veel mensen producten lekkerder smaken als deze zoet zijn.
De opkomst van welvaartziektes
Sinds de toename van onze suikerconsumptie is er ook een sterk stijgende lijn in de welvaartziektes waar we tegenwoordig niet meer omheen kunnen. Denk hierbij aan diabetes type 2, diabetes type 3 (alzheimer), insulineresistentie, voedselintoleranties en tot slot kanker. Nu hoor ik je denken, huh? Kanker is toch geen welvaartsziekte? Maar dat is het helaas wel. Want wist je dat in de culturen waarbij er geen koolhydraatrijke en suikerrijke voeding genuttigd wordt er ook geen gevallen van kanker geconstateerd worden? Dat is toch wel bijzonder hè…
Helaas wordt deze kennis wegens de commerciële belangen actief weg gehouden uit de wetenschappelijke wereld en de media door de voedingsmiddelenindustrie. Meerdere belangrijke wetenschappers werden zelfs beloond voor het geven van de schuld aan (gezonde) vetten. Zo kwam het advies in de wereld om vetten zo veel als mogelijk te vermijden, waarbij suikers vaak gebruik werden om de alternatieve vetarme producten smaak te geven. En toch komt suiker schrikbarend genoeg niet uit de toxicologische testen als “kankerverwekkend”, hoe dit kan? Dat heeft alles te maken met het eerder genoemde proces waarbij de mitochondriën beschadigd raken. Suiker op zichzelf bevat geen kankerverwekkende stoffen, dat is waar op getest wordt, maar er wordt hierbij niet gekeken naar wat er vervolgens met de suiker gebeurt als het in ons lichaam is. Suiker veroorzaakt namelijk chronische ontstekingen, die de mitochondriën beschadigen. Eerder in dit artikel heb je kunnen lezen waar de mitochondriën verantwoordelijk voor zijn en wat er gebeurt als deze beschadigd raken (het vormen van een kankercel).
Kanker en diabetes in combinatie van overgewicht
In 2003 werd voor het eerst duidelijk dat de sterfte aan kanker verband houdt met overgewicht en obesitas. Er werd aangetoond dat hoe zwaarder je bent, des te meer risico je hebt om kanker te ontwikkelen. Ook kan een teveel aan vetweefsel zorgen voor een te veel van het hormoon oestrogeen, dit is een hormoon die de groei kan stimuleren van hormoongevoelige kankercellen zoals borstkanker en baarmoederkanker. Patiënten met borstkanker die overgewicht hebben hebben dan ook een veel slechtere prognose en komen sneller te overleiden.
Uit bevolkingsonderzoeken blijkt dat obesitas en diabetes type 2 en 3 zeer vaak samengaan (mensen met diabetes hebben vaak overgewicht, mensen met overgewicht hebben vaak diabetes). Mensen met diabetes hebben een verhoogd risico op kanker. Dit heeft alles te maken met de ontregelde verwerking van suiker bij mensen die diabetes hebben. Hierdoor worden de mitochondriën aangetast, is er vaak veel suiker in het bloed aanwezig en is er vaak sprake van chronische ontstekingen (die invloed hebben op de vorming van kankercellen).
Insuline is een veel voorgeschreven product bij mensen die lijden aan diabetes. De insuline zorgt ervoor dat de suiker die door onze voeding ingenomen wordt opgenomen kan worden in het bloed. Normaal gesproken maakt je lichaam zelf insuline aan, maar indien je lijdt aan diabetes kan je lichaam dit niet meer voldoende, dan is er namelijk sprake van insulineresistentie. Studies uit het Verenigde Koninkrijk en Canada laten zien dat patiënten die chronisch met insuline worden behandeld zelfs 40 tot 90 % meer kans hebben op het ontwikkelen van kanker. Het is dan ook schrikbarend dat zo veel artsen vandaag de dag nog steeds insuline voorschrijven, zeker aangezien de klachten van diabetes type 2 ook aangepakt kunnen worden met andere voeding (verandering van je voedingspatroon/levensstijl). In veel gevallen kunnen mensen met diabetes type 2 zelfs volledig klachtvrij worden door hun voedingspatroon aan te passen. Lees hier meer over diabetes type 2 en het aanpassen van je voedingspatroon.
Suiker veroorzaakt chronische ontstekingen
Dat chronische ontstekingen vaak voorafgaan aan de vorming van kankercellen is eerder in dit artikel toegelicht. Diverse onderzoeken hebben laten zien dat de regelmatige consumptie van suiker een belangrijke oorzaak is in het ontstaan van chronische ontstekingen. Hetzelfde geldt voor snel verteerbare koolhydraten, want zoals je eerder op de afbeelding hebt kunnen zien wordt dit in je lichaam omgezet naar glucose (suiker), denk hierbij aan frisdranken, zetmeelrijke producten en industrieel bewerkte voedingsmiddelen. Deze producten veroorzaken namelijk hoge bloedsuikerspiegels, met de daarbij behorende verhoging van de ontstekingsgraad. Een overschot aan glucose beschadigd de mitochondriën, wat vervolgens de ontsteking van onze cellen veroorzaakt.
Dat mensen die leiden aan diabetes een hogere kans hebben op ontstekingen dat is bij de meeste mensen wel bekend, denk hierbij alleen al aan het risico op wondjes die niet goed genezen die uiteindelijk zelfs kunnen leiden tot de amputatie van een voet of been. Dit komt mede doordat wondjes niet goed kunnen genezen wegens een slechte doorbloeding (waar mensen met diabetes vaak last van hebben), maar ook door de verhoogde kans op ontstekingen wegens te hoge glucosewaarden. Maar ook is het immuunsysteem (afweersysteem) van mensen met diabetes vaak slechter. Indien je een slecht immuunsysteem hebt ben je vatbaarder voor bacteriën en ontstekingen. Zoals je kunt zien is dat dus een vicieuze cirkel die allemaal samenhangt met de consumptie van suikers.
Fructose is nog schadelijker dan glucose
Vroeger werd gedacht dat fructose (ook wel bekend als vruchtensuiker) onschuldig was omdat dit een minder effect toont op de bloedsuikerspiegel. Fructose wordt namelijk voor het grootste deel in de lever omgezet naar vetzuren, die in de lever en ons vetweefsel worden opgeslagen. Om die reden kregen diabetici vroeger ook vaak het advies om fructose te gebruiken als zoetmiddel, ter vervanging van gewone suiker. Maar ondertussen is bekend dat fructose eigenlijk helemaal niet zo veilig is en juist veel schade veroorzaakt. Onderzoeken hebben namelijk aangetoond dat fructose een direct beschadigende invloed heeft op de mitochondriën, waarbij er onherstelbare schade optreed in de mitochondriën en fructose er tevens voor zorgt dat er geen nieuwe mitochondriën aangemaakt kunnen worden. Maar dat is nog niet alles. Onderzoek toont ook aan dat fructose kankercellen juist helpt om sneller het voor de kankercel noodzakelijke nieuwe DNA te kunnen aanmaken, waardoor tumoren en uitzaaiingen nog sneller kunnen groeien.
Te bizar voor woorden
Met bovenstaande kennis is het eigenlijk te bizar voor woorden dat schadelijke sigaretten een speciaal schap in de supermarkt hebben en niet zomaar verkrijgbaar zijn, maar dat suiker en suikerrijke producten geen enkele waarschuwing op de verpakking hebben, vrij verkrijgbaar zijn en door alle leeftijden gekocht kunnen worden. Sterker nog, heel veel suikerrijke producten zijn zelfs bestempeld met het kies bewust logo, slogans zoals “Goed bezig!” en ga zo maar door. BIZAR!
Voedingsadvies
Het voedingscentrum en vele artsen adviseren vandaag de dag nog steeds de welbekende “schijf van 5”. De schijf van 5 is door de jaren heen wel iets aangepast, maar helaas zijn de verhoudingen en producten die geadviseerd worden nog steeds heel slecht voor ons lijf. Denk hierbij aan granen, grotere hoeveelheden zuivel, suikerrijk fruit, ongezonde vetten zoals margarine en zonnebloemolie, etc… Als je kijkt naar welke grote bedrijven de sponsoren zijn van het voedingscentrum, dan vind ik dit advies logisch… Maar als je kijkt naar de wetenschappelijke onderzoeken over voeding en naar de kennis die we inmiddels hebben over wat daadwerkelijk goed is voor ons lichaam, dan schrik ik echt van deze keuzes en adviezen.
Jouw leefstijl veranderen
Er zijn meerdere aanpassingen die je kunt maken in jouw levensstijl om de preventie of de strijd tegen kanker aan te kunnen gaan. Bij Xandra’s Keto Kitchen richten we ons op 2 leefstijlen die bewezen effecten hebben aangetoond, namelijk ketogeen eten en intermittent fasting. Tot voor kort werd er door de medische wetenschap nogal lacherig over gedaan om deze methoden toe te passen in de preventie en behandeling van kanker, maar tegenwoordig wordt dit door een steeds groter groeiende groep wetenschappers bloedserieus genomen.
Verander je energiebron
Wij hebben 3 groepen van energiemiddelen die wij kunnen gebruiken om energie uit te halen om te kunnen leven. Namelijk koolhydraten, eiwitten en vetten. In een westers dieet is het het meest gebruikelijk om koolhydraten als grootse energiebron te nuttigen, aangevuld met eiwitten en een kleine hoeveelheid vetten. Bij een ketogeen levensstijl is deze juist omgedraaid. Gemiddeld 70 % van jouw voeding bestaat uit gezonde vetten, aangevuld met een matige hoeveelheid eiwit en een kleine hoeveelheid koolhydraten.
Zoals je eerder in dit artikel hebt kunnen lezen kunnen kankercellen alleen maar energie halen uit glucose en glutamine. Glucose wordt gevormd door koolhydraten en glutamine door eiwitten. Dit zijn 2 van de 3 energiemiddelen die je bij een ketogeen levensstijl beperkt, vetten worden je hoofdbrandstof. Door de inname van koolhydraten en glutamine te beperken ontstaat er een gebrek aan energie voor bestaande kankercellen, maar ook verlaag je hiermee drastisch de kankerstimulerende hormonen in je lichaam. Door het ontstaan van een gebrek aan energie in de kankercellen kunnen hun delingen en groei worden vertraagd, of in sommige gevallen zelfs helemaal stilgezet. Ook worden de kankercellen hierdoor vatbaarder voor de effecten van chemotherapie en bestraling, want hoe zwakker een cel is door gebrek aan energie, hoe minder weerstand het kan bieden. Hierdoor kunnen de kankercellen sneller en beter vernietigd worden. En wat ook een mooi extra voordeel is, is dat door de vele gezondheidsvoordelen van ketogeen eten en intermittend fasting bij veel mensen de vervelende bijwerkingen van deze 2 therapieën worden verminderd.
Waarom adviseert de oncoloog hier niet veel over?
Wanneer er kanker bij je is vastgesteld zal je zeer waarschijnlijk van de oncoloog een aantal adviezen krijgen om daarmee jouw leefstijl te verbeteren, waaronder niet roken, meer bewegen en gezonder eten. Echter zal je hier waarschijnlijk geen diepgaande informatie over krijgen en zal de oncoloog zich vooral richten op het behandelplan, dat is immers het vak van de oncoloog. Maar ook is het (helaas) zo dat de oncoloog niet of nauwelijks opgeleid is op het gebied van de relatie van voeding of andere aspecten van je leefstijl met de preventie van kanker, laat staan met het behandelen daarvan. De meerderheid van congressen en medische publicaties over kanker gaan voornamelijk over nieuwe dure therapieën, waar de belangen duidelijk zijn. De besproken onderzoeken worden gesponsord door de farmaceutische industrie, die (begrijpelijk) alleen geld kan verdienen met nieuwe pattenteerbare middelen. De geneeskunde hoe die zich in de laatste eeuw heeft ontwikkeld is vooral gericht op het bestrijden van problemen, niet op het voorkomen hiervan. Maar ook op hoe er zo veel mogelijk geld verdiend kan worden bij het behandelen van ziektes, waarbij de (zo goed als gratis) optie van je voeding aanpassen natuurlijk niet interessant is als het gaat om de financiële industrie die zich achter geneeskunde bevindt.
Anderen lezen ook
💡De gezondheidsvoordelen van ketogeen eten
💡Keto voor beginners
💡Ziekenhuisopname en keto
Bronnen
Johnson SB, Park HS, Gross CP, Yu JB. Use of Alternative Medicine for Cancer and Its Impact on Survival. J Natl Cancer Inst. 2018 Jan 1;110(1). doi: 10.1093/jnci/djx145. PMID: 28922780.
Johnson SB, Park HS, Gross CP, Yu JB. Complementary Medicine, Refusal of Conventional Cancer Therapy, and Survival Among Patients With Curable Cancers. JAMA Oncol. 2018 Oct 1;4(10):1375-1381. doi: 10.1001/jamaoncol.2018.2487. PMID: 30027204; PMCID: PMC6233773.
Nederlandse cijfers over kanker.
Ahmad AS, Ormiston-Smith N, Sasieni PD. Trends in the lifetime risk of developing cancer in Great Britain: comparison of risk for those born from 1930 to 1960. Br J Cancer. 2015 Mar 3;112(5):943-7. doi: 10.1038/bjc.2014.606. Epub 2015 Feb 3. PMID: 25647015; PMCID: PMC4453943.
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000 Jan 7;100(1):57-70. doi: 10.1016/s0092-8674(00)81683-9. PMID: 10647931.
Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Piñeros M, Znaor A, Bray F. Cancer statistics for the year 2020: An overview. Int J Cancer. 2021 Apr 5. doi: 10.1002/ijc.33588. Epub ahead of print. PMID: 33818764.
Tabár L, Dean PB, Chen TH, Yen AM, Chen SL, Fann JC, Chiu SY, Ku MM, Wu WY, Hsu CY, Chen YC, Beckmann K, Smith RA, Duffy SW. The incidence of fatal breast cancer measures the increased effectiveness of therapy in women participating in mammography screening. Cancer. 2019 Feb 15;125(4):515-523. doi: 10.1002/cncr.31840. Epub 2018 Nov 8. PMID: 30411328; PMCID: PMC6588008.
Warburg O, Wind F, Negelein E. THE METABOLISM OF TUMORS IN THE BODY. J Gen Physiol. 1927 Mar 7;8(6):519-30. doi: 10.1085/jgp.8.6.519. PMID: 19872213; PMCID: PMC2140820.
Steele CB, Thomas CC, Henley SJ, Massetti GM, Galuska DA, Agurs-Collins T, Puckett M, Richardson LC. Vital Signs: Trends in Incidence of Cancers Associated with Overweight and Obesity – United States, 2005-2014. MMWR Morb Mortal Wkly Rep. 2017 Oct 3;66(39):1052-1058. doi: 10.15585/mmwr.mm6639e1. PMID: 28981482; PMCID: PMC5720881.
Ohkuma T, Peters SAE, Woodward M. Sex differences in the association between diabetes and cancer: a systematic review and meta-analysis of 121 cohorts including 20 million individuals and one million events. Diabetologia. 2018 Oct;61(10):2140-2154. doi: 10.1007/s00125-018-4664-5. Epub 2018 Jul 20. PMID: 30027404; PMCID: PMC6133170.
El Kinany, K., Huybrechts, I., Hatime, Z. et al. Food processing groups and colorectal cancer risk in Morocco: evidence from a nationally representative case–control study. Eur J Nutr 61, 2507–2515 (2022). https://doi.org/10.1007/s00394-022-02820-3
Chazelas E, Srour B, Desmetz E, Kesse-Guyot E, Julia C, Deschamps V et al. Sugary drink consumption and risk of cancer: results from NutriNet-Santé prospective cohort BMJ 2019; 366 :l2408 doi:10.1136/bmj.l2408
Hodge AM, Bassett JK, Milne RL, English DR, Giles GG. Consumption of sugar-sweetened and artificially sweetened soft drinks and risk of obesity-related cancers. Public Health Nutr. 2018 Jun;21(9):1618-1626. doi: 10.1017/S1368980017002555. Epub 2018 Feb 21. PMID: 29463332; PMCID: PMC10261409.
Christ A, Günther P, Lauterbach MAR, Duewell P, Biswas D, Pelka K, Scholz CJ, Oosting M, Haendler K, Baßler K, Klee K, Schulte-Schrepping J, Ulas T, Moorlag SJCFM, Kumar V, Park MH, Joosten LAB, Groh LA, Riksen NP, Espevik T, Schlitzer A, Li Y, Fitzgerald ML, Netea MG, Schultze JL, Latz E. Western Diet Triggers NLRP3-Dependent Innate Immune Reprogramming. Cell. 2018 Jan 11;172(1-2):162-175.e14. doi: 10.1016/j.cell.2017.12.013. PMID: 29328911; PMCID: PMC6324559.
Martincorena I, Raine KM, Gerstung M, Dawson KJ, Haase K, Van Loo P, Davies H, Stratton MR, Campbell PJ. Universal Patterns of Selection in Cancer and Somatic Tissues. Cell. 2017 Nov 16;171(5):1029-1041.e21. doi: 10.1016/j.cell.2017.09.042. Epub 2017 Oct 19. Erratum in: Cell. 2018 Jun 14;173(7):1823. PMID: 29056346; PMCID: PMC5720395.
Goodson WH 3rd, Lowe L, Carpenter DO, Gilbertson M, Manaf Ali A, Lopez de Cerain Salsamendi A, Lasfar A, Carnero A, Azqueta A, Amedei A, Charles AK, Collins AR, Ward A, Salzberg AC, Colacci A, Olsen AK, Berg A, Barclay BJ, Zhou BP, Blanco-Aparicio C, Baglole CJ, Dong C, Mondello C, Hsu CW, Naus CC, Yedjou C, Curran CS, Laird DW, Koch DC, Carlin DJ, Felsher DW, Roy D, Brown DG, Ratovitski E, Ryan EP, Corsini E, Rojas E, Moon EY, Laconi E, Marongiu F, Al-Mulla F, Chiaradonna F, Darroudi F, Martin FL, Van Schooten FJ, Goldberg GS, Wagemaker G, Nangami GN, Calaf GM, Williams G, Wolf GT, Koppen G, Brunborg G, Lyerly HK, Krishnan H, Ab Hamid H, Yasaei H, Sone H, Kondoh H, Salem HK, Hsu HY, Park HH, Koturbash I, Miousse IR, Scovassi AI, Klaunig JE, Vondráček J, Raju J, Roman J, Wise JP Sr, Whitfield JR, Woodrick J, Christopher JA, Ochieng J, Martinez-Leal JF, Weisz J, Kravchenko J, Sun J, Prudhomme KR, Narayanan KB, Cohen-Solal KA, Moorwood K, Gonzalez L, Soucek L, Jian L, D’Abronzo LS, Lin LT, Li L, Gulliver L, McCawley LJ, Memeo L, Vermeulen L, Leyns L, Zhang L, Valverde M, Khatami M, Romano MF, Chapellier M, Williams MA, Wade M, Manjili MH, Lleonart ME, Xia M, Gonzalez MJ, Karamouzis MV, Kirsch-Volders M, Vaccari M, Kuemmerle NB, Singh N, Cruickshanks N, Kleinstreuer N, van Larebeke N, Ahmed N, Ogunkua O, Krishnakumar PK, Vadgama P, Marignani PA, Ghosh PM, Ostrosky-Wegman P, Thompson PA, Dent P, Heneberg P, Darbre P, Sing Leung P, Nangia-Makker P, Cheng QS, Robey RB, Al-Temaimi R, Roy R, Andrade-Vieira R, Sinha RK, Mehta R, Vento R, Di Fiore R, Ponce-Cusi R, Dornetshuber-Fleiss R, Nahta R, Castellino RC, Palorini R, Abd Hamid R, Langie SA, Eltom SE, Brooks SA, Ryeom S, Wise SS, Bay SN, Harris SA, Papagerakis S, Romano S, Pavanello S, Eriksson S, Forte S, Casey SC, Luanpitpong S, Lee TJ, Otsuki T, Chen T, Massfelder T, Sanderson T, Guarnieri T, Hultman T, Dormoy V, Odero-Marah V, Sabbisetti V, Maguer-Satta V, Rathmell WK, Engström W, Decker WK, Bisson WH, Rojanasakul Y, Luqmani Y, Chen Z, Hu Z. Assessing the carcinogenic potential of low-dose exposures to chemical mixtures in the environment: the challenge ahead. Carcinogenesis. 2015 Jun;36 Suppl 1(Suppl 1):S254-96. doi: 10.1093/carcin/bgv039. Erratum in: Carcinogenesis. 2016 Mar;37(3):344. PMID: 26106142; PMCID: PMC4480130.
Salzberg, S.L. Open questions: How many genes do we have?. BMC Biol 16, 94 (2018). https://doi.org/10.1186/s12915-018-0564-x
Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001 Feb 17;357(9255):539-45. doi: 10.1016/S0140-6736(00)04046-0. PMID: 11229684.
Maeda H, Akaike T. Nitric oxide and oxygen radicals in infection, inflammation, and cancer. Biochemistry (Mosc). 1998 Jul;63(7):854-65. PMID: 9721338.
Shaked H, Hofseth LJ, Chumanevich A, Chumanevich AA, Wang J, Wang Y, Taniguchi K, Guma M, Shenouda S, Clevers H, Harris CC, Karin M. Chronic epithelial NF-κB activation accelerates APC loss and intestinal tumor initiation through iNOS up-regulation. Proc Natl Acad Sci U S A. 2012 Aug 28;109(35):14007-12. doi: 10.1073/pnas.1211509109. Epub 2012 Aug 14. PMID: 22893683; PMCID: PMC3435160.
Grivennikov SI, Wang K, Mucida D, Stewart CA, Schnabl B, Jauch D, Taniguchi K, Yu GY, Osterreicher CH, Hung KE, Datz C, Feng Y, Fearon ER, Oukka M, Tessarollo L, Coppola V, Yarovinsky F, Cheroutre H, Eckmann L, Trinchieri G, Karin M. Adenoma-linked barrier defects and microbial products drive IL-23/IL-17-mediated tumour growth. Nature. 2012 Nov 8;491(7423):254-8. doi: 10.1038/nature11465. PMID: 23034650; PMCID: PMC3601659.
Wang K, Kim MK, Di Caro G, Wong J, Shalapour S, Wan J, Zhang W, Zhong Z, Sanchez-Lopez E, Wu LW, Taniguchi K, Feng Y, Fearon E, Grivennikov SI, Karin M. Interleukin-17 receptor a signaling in transformed enterocytes promotes early colorectal tumorigenesis. Immunity. 2014 Dec 18;41(6):1052-63. doi: 10.1016/j.immuni.2014.11.009. Epub 2014 Nov 25. PMID: 25526314; PMCID: PMC4272447.
Dela Cruz CS, Kang MJ. Mitochondrial dysfunction and damage associated molecular patterns (DAMPs) in chronic inflammatory diseases. Mitochondrion. 2018 Jul;41:37-44. doi: 10.1016/j.mito.2017.12.001. Epub 2017 Dec 6. PMID: 29221810; PMCID: PMC5988941.
Olsen I, Yilmaz Ö. Possible role of Porphyromonas gingivalis in orodigestive cancers. J Oral Microbiol. 2019 Jan 9;11(1):1563410. doi: 10.1080/20002297.2018.1563410. PMID: 30671195; PMCID: PMC6327928.
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000 Jan 7;100(1):57-70. doi: 10.1016/s0092-8674(00)81683-9. PMID: 10647931.
Fisher B, Montague E, Redmond C, Barton B, Borland D, Fisher ER, Deutsch M, Schwarz G, Margolese R, Donegan W, Volk H, Konvolinka C, Gardner B, Cohn I Jr, Lesnick G, Cruz AB, Lawrence W, Nealon T, Butcher H, Lawton R. Comparison of radical mastectomy with alternative treatments for primary breast cancer. A first report of results from a prospective randomized clinical trial. Cancer. 1977 Jun;39(6 Suppl):2827-39. doi: 10.1002/1097-0142(197706)39:6<2827::aid-cncr2820390671>3.0.co;2-i. PMID: 326381./a>
Fisher B, Bauer M, Margolese R, Poisson R, Pilch Y, Redmond C, Fisher E, Wolmark N, Deutsch M, Montague E, et al. Five-year results of a randomized clinical trial comparing total mastectomy and segmental mastectomy with or without radiation in the treatment of breast cancer. N Engl J Med. 1985 Mar 14;312(11):665-73. doi: 10.1056/NEJM198503143121101. PMID: 3883167.
Fisher B, Redmond C, Fisher ER, Bauer M, Wolmark N, Wickerham DL, Deutsch M, Montague E, Margolese R, Foster R. Ten-year results of a randomized clinical trial comparing radical mastectomy and total mastectomy with or without radiation. N Engl J Med. 1985 Mar 14;312(11):674-81. doi: 10.1056/NEJM198503143121102. PMID: 3883168.
Kurosawa S, Kato M. Anesthetics, immune cells, and immune responses. J Anesth. 2008;22(3):263-77. doi: 10.1007/s00540-008-0626-2. Epub 2008 Aug 7. PMID: 18685933.
Amodeo G, Bugada D, Franchi S, Moschetti G, Grimaldi S, Panerai A, Allegri M, Sacerdote P. Immune function after major surgical interventions: the effect of postoperative pain treatment. J Pain Res. 2018 Jul 10;11:1297-1305. doi: 10.2147/JPR.S158230. PMID: 30022848; PMCID: PMC6044362.
Cata JP, Bauer M, Sokari T, Ramirez MF, Mason D, Plautz G, Kurz A. Effects of surgery, general anesthesia, and perioperative epidural analgesia on the immune function of patients with non-small cell lung cancer. J Clin Anesth. 2013 Jun;25(4):255-62. doi: 10.1016/j.jclinane.2012.12.007. Epub 2013 May 7. PMID: 23659826.
Pearce MS, Salotti JA, Little MP, McHugh K, Lee C, Kim KP, Howe NL, Ronckers CM, Rajaraman P, Sir Craft AW, Parker L, Berrington de González A. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study. Lancet. 2012 Aug 4;380(9840):499-505. doi: 10.1016/S0140-6736(12)60815-0. Epub 2012 Jun 7. PMID: 22681860; PMCID: PMC3418594.
Pauwels EK, Foray N, Bourguignon MH. Breast Cancer Induced by X-Ray Mammography Screening? A Review Based on Recent Understanding of Low-Dose Radiobiology. Med Princ Pract. 2016;25(2):101-9. doi: 10.1159/000442442. Epub 2015 Nov 16. PMID: 26571215; PMCID: PMC5588356.
Panigrahy D, Gartung A, Yang J, Yang H, Gilligan MM, Sulciner ML, Bhasin SS, Bielenberg DR, Chang J, Schmidt BA, Piwowarski J, Fishbein A, Soler-Ferran D, Sparks MA, Staffa SJ, Sukhatme V, Hammock BD, Kieran MW, Huang S, Bhasin M, Serhan CN, Sukhatme VP. Preoperative stimulation of resolution and inflammation blockade eradicates micrometastases. J Clin Invest. 2019 Jun 17;129(7):2964-2979. doi: 10.1172/JCI127282. PMID: 31205032; PMCID: PMC6597207.
Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature. 2014 Jun 5;510(7503):92-101. doi: 10.1038/nature13479. PMID: 24899309; PMCID: PMC4263681.
Sulciner ML, Serhan CN, Gilligan MM, Mudge DK, Chang J, Gartung A, Lehner KA, Bielenberg DR, Schmidt B, Dalli J, Greene ER, Gus-Brautbar Y, Piwowarski J, Mammoto T, Zurakowski D, Perretti M, Sukhatme VP, Kaipainen A, Kieran MW, Huang S, Panigrahy D. Resolvins suppress tumor growth and enhance cancer therapy. J Exp Med. 2018 Jan 2;215(1):115-140. doi: 10.1084/jem.20170681. Epub 2017 Nov 30. PMID: 29191914; PMCID: PMC5748851.
Ichim G, Tait SW. A fate worse than death: apoptosis as an oncogenic process. Nat Rev Cancer. 2016 Aug;16(8):539-48. doi: 10.1038/nrc.2016.58. Epub 2016 Jul 1. PMID: 27364482.
Gregory CD, Pound JD. Cell death in the neighbourhood: direct microenvironmental effects of apoptosis in normal and neoplastic tissues. J Pathol. 2011 Jan;223(2):177-94. doi: 10.1002/path.2792. Epub 2010 Oct 25. PMID: 21125674.
Kirsten Lauber, Martin Herrmann, Tumor Biology: With a Little Help from My Dying Friends, Current Biology, Volume 25, Issue 5, 2015, Pages R198-R201, ISSN 0960-9822, https://doi.org/10.1016/j.cub.2015.01.040 (https://www.sciencedirect.com/science/article/pii/S096098221500072X)
Abstract: Summary Apoptosis is an essential form of cell death underlying daily tissue regeneration. In tumor biology, apoptosis resistance is a well-established hallmark of cancer that is targeted by therapeutic approaches. A new study assigns a hitherto-underestimated function to this ‘deadly friend’: apoptotic cells promote tumor growth, accumulation of tumor-associated macrophages, and angiogenesis.
Chen T, Guo J, Han C, Yang M, Cao X. Heat shock protein 70, released from heat-stressed tumor cells, initiates antitumor immunity by inducing tumor cell chemokine production and activating dendritic cells via TLR4 pathway. J Immunol. 2009 Feb 1;182(3):1449-59. doi: 10.4049/jimmunol.182.3.1449. PMID: 19155492.
Wust P, Hildebrandt B, Sreenivasa G, Rau B, Gellermann J, Riess H, Felix R, Schlag PM. Hyperthermia in combined treatment of cancer. Lancet Oncol. 2002 Aug;3(8):487-97. doi: 10.1016/s1470-2045(02)00818-5. PMID: 12147435.
Lazzari C, Karachaliou N, Bulotta A, Viganó M, Mirabile A, Brioschi E, Santarpia M, Gianni L, Rosell R, Gregorc V. Combination of immunotherapy with chemotherapy and radiotherapy in lung cancer: is this the beginning of the end for cancer? Ther Adv Med Oncol. 2018 Apr 6;10:1758835918762094. doi: 10.1177/1758835918762094. PMID: 29662546; PMCID: PMC5894901.
Fares CM, Van Allen EM, Drake CG, Allison JP, Hu-Lieskovan S. Mechanisms of Resistance to Immune Checkpoint Blockade: Why Does Checkpoint Inhibitor Immunotherapy Not Work for All Patients? Am Soc Clin Oncol Educ Book. 2019 Jan;39:147-164. doi: 10.1200/EDBK_240837. Epub 2019 May 17. PMID: 31099674.
Bajwa R, Cheema A, Khan T, Amirpour A, Paul A, Chaughtai S, Patel S, Patel T, Bramson J, Gupta V, Levitt M, Asif A, Hossain MA. Adverse Effects of Immune Checkpoint Inhibitors (Programmed Death-1 Inhibitors and Cytotoxic T-Lymphocyte-Associated Protein-4 Inhibitors): Results of a Retrospective Study. J Clin Med Res. 2019 Apr;11(4):225-236. doi: 10.14740/jocmr3750. Epub 2019 Mar 18. PMID: 30937112; PMCID: PMC6436564.
Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012 Mar 22;12(4):252-64. doi: 10.1038/nrc3239. PMID: 22437870; PMCID: PMC4856023.
Drolet M, Bénard É, Pérez N, Brisson M; HPV Vaccination Impact Study Group. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. Lancet. 2019 Aug 10;394(10197):497-509. doi: 10.1016/S0140-6736(19)30298-3. Epub 2019 Jun 26. PMID: 31255301; PMCID: PMC7316527.
Lawrence MS, Stojanov P, Mermel CH, Robinson JT, Garraway LA, Golub TR, Meyerson M, Gabriel SB, Lander ES, Getz G. Discovery and saturation analysis of cancer genes across 21 tumour types. Nature. 2014 Jan 23;505(7484):495-501. doi: 10.1038/nature12912. Epub 2014 Jan 5. PMID: 24390350; PMCID: PMC4048962.
Tanaka LF, Latorre MRDO, Gutierrez EB, Curado MP, Froeschl G, Heumann C, Herbinger KH. Risk for cancer among people living with AIDS, 1997-2012: the São Paulo AIDS-cancer linkage study. Eur J Cancer Prev. 2018 Jul;27(4):411-417. doi: 10.1097/CEJ.0000000000000339. PMID: 28059857.
Engels EA, Pfeiffer RM, Fraumeni JF Jr, Kasiske BL, Israni AK, Snyder JJ, Wolfe RA, Goodrich NP, Bayakly AR, Clarke CA, Copeland G, Finch JL, Fleissner ML, Goodman MT, Kahn A, Koch L, Lynch CF, Madeleine MM, Pawlish K, Rao C, Williams MA, Castenson D, Curry M, Parsons R, Fant G, Lin M. Spectrum of cancer risk among US solid organ transplant recipients. JAMA. 2011 Nov 2;306(17):1891-901. doi: 10.1001/jama.2011.1592. PMID: 22045767; PMCID: PMC3310893.
Dahlke E, Murray CA, Kitchen J, Chan AW. Systematic review of melanoma incidence and prognosis in solid organ transplant recipients. Transplant Res. 2014 May 6;3:10. doi: 10.1186/2047-1440-3-10. PMID: 24834346; PMCID: PMC4022534.
Herberman RB, Ortaldo JR. Natural killer cells: their roles in defenses against disease. Science. 1981 Oct 2;214(4516):24-30. doi: 10.1126/science.7025208. PMID: 7025208.
Gasser S, Raulet D. The DNA damage response, immunity and cancer. Semin Cancer Biol. 2006 Oct;16(5):344-7. doi: 10.1016/j.semcancer.2006.07.004. Epub 2006 Jul 7. PMID: 16914325.
Bauer S, Groh V, Wu J, Steinle A, Phillips JH, Lanier LL, Spies T. Activation of NK cells and T cells by NKG2D, a receptor for stress-inducible MICA. Science. 1999 Jul 30;285(5428):727-9. doi: 10.1126/science.285.5428.727. PMID: 10426993.
Afshar-Sterle S, Zotos D, Bernard NJ, Scherger AK, Rödling L, Alsop AE, Walker J, Masson F, Belz GT, Corcoran LM, O’Reilly LA, Strasser A, Smyth MJ, Johnstone R, Tarlinton DM, Nutt SL, Kallies A. Fas ligand-mediated immune surveillance by T cells is essential for the control of spontaneous B cell lymphomas. Nat Med. 2014 Mar;20(3):283-90. doi: 10.1038/nm.3442. Epub 2014 Feb 2. PMID: 24487434.
Cotter TG. Apoptosis and cancer: the genesis of a research field. Nat Rev Cancer. 2009 Jul;9(7):501-7. doi: 10.1038/nrc2663. PMID: 19550425.
Druker BJ, Guilhot F, O’Brien SG, Gathmann I, Kantarjian H, Gattermann N, Deininger MW, Silver RT, Goldman JM, Stone RM, Cervantes F, Hochhaus A, Powell BL, Gabrilove JL, Rousselot P, Reiffers J, Cornelissen JJ, Hughes T, Agis H, Fischer T, Verhoef G, Shepherd J, Saglio G, Gratwohl A, Nielsen JL, Radich JP, Simonsson B, Taylor K, Baccarani M, So C, Letvak L, Larson RA; IRIS Investigators. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006 Dec 7;355(23):2408-17. doi: 10.1056/NEJMoa062867. PMID: 17151364.
Druker BJ, Sawyers CL, Kantarjian H, Resta DJ, Reese SF, Ford JM, Capdeville R, Talpaz M. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med. 2001 Apr 5;344(14):1038-42. doi: 10.1056/NEJM200104053441402. Erratum in: N Engl J Med 2001 Jul 19;345(3):232. PMID: 11287973.
Wessalowski R, Schneider DT, Mils O, Friemann V, Kyrillopoulou O, Schaper J, Matuschek C, Rothe K, Leuschner I, Willers R, Schönberger S, Göbel U, Calaminus G; MAKEI study group. Regional deep hyperthermia for salvage treatment of children and adolescents with refractory or recurrent non-testicular malignant germ-cell tumours: an open-label, non-randomised, single-institution, phase 2 study. Lancet Oncol. 2013 Aug;14(9):843-52. doi: 10.1016/S1470-2045(13)70271-7. Epub 2013 Jul 1. PMID: 23823158.
Issels R, Kampmann E, Kanaar R, Lindner LH. Hallmarks of hyperthermia in driving the future of clinical hyperthermia as targeted therapy: translation into clinical application. Int J Hyperthermia. 2016;32(1):89-95. doi: 10.3109/02656736.2015.1119317. Epub 2016 Jan 24. PMID: 26803991.
Angele MK, Albertsmeier M, Prix NJ, Hohenberger P, Abdel-Rahman S, Dieterle N, Schmidt M, Mansmann U, Bruns CJ, Issels RD, Jauch KW, Lindner LH. Effectiveness of regional hyperthermia with chemotherapy for high-risk retroperitoneal and abdominal soft-tissue sarcoma after complete surgical resection: a subgroup analysis of a randomized phase-III multicenter study. Ann Surg. 2014 Nov;260(5):749-54; discussion 754-6. doi: 10.1097/SLA.0000000000000978. PMID: 25379845; PMCID: PMC4514521.
Issels RD, Lindner LH, Verweij J, Wessalowski R, Reichardt P, Wust P, Ghadjar P, Hohenberger P, Angele M, Salat C, Vujaskovic Z, Daugaard S, Mella O, Mansmann U, Dürr HR, Knösel T, Abdel-Rahman S, Schmidt M, Hiddemann W, Jauch KW, Belka C, Gronchi A; European Organization for the Research and Treatment of Cancer-Soft Tissue and Bone Sarcoma Group and the European Society for Hyperthermic Oncology. Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma: The EORTC 62961-ESHO 95 Randomized Clinical Trial. JAMA Oncol. 2018 Apr 1;4(4):483-492. doi: 10.1001/jamaoncol.2017.4996. Erratum in: JAMA Oncol. 2018 Apr 1;4(4):590. PMID: 29450452; PMCID: PMC5885262.
Watson J. Crick F. A structure for deoxyribose nucleic acid. Nature. 1953; 171,
737-738.
Human Cancers Express a Mutator Phenotype: Hypothesis, Origin, and Consequences
Thomas N. Seyfried, Roberto E. Flores, Angela M. Poff, Dominic P. D’Agostino, Cancer as a metabolic disease: implications for novel therapeutics, Carcinogenesis, Volume 35, Issue 3, March 2014, Pages 515–527, https://doi.org/10.1093/carcin/bgt480
Planavsky, N., Asael, D., Hofmann, A. et al. Evidence for oxygenic photosynthesis half a billion years before the Great Oxidation Event. Nature Geosci 7, 283–286 (2014). https://doi.org/10.1038/ngeo2122
When did oxygenic photosynthesis evolve? | Philosophical Transactions of the Royal Society B: Biological Sciences
Johannes M. Herrmann and Jan Riemer.
The Intermembrane Space of Mitochondria.
Antioxidants & Redox Signaling.Nov 2010.1341-1358.http://doi.org/10.1089/ars.2009.3063
Maria van Gurp, Nele Festjens, Geert van Loo, Xavier Saelens, Peter Vandenabeele,
Mitochondrial intermembrane proteins in cell death, Biochemical and Biophysical Research Communications, Volume 304, Issue 3, 2003, Pages 487-497, ISSN 0006-291X, https://doi.org/10.1016/S0006-291X(03)00621-1.
(https://www.sciencedirect.com/science/article/pii/S0006291X03006211)
Abstract: Apoptosis is a form of programmed cell death important in the development and tissue homeostasis of multicellular organisms. Mitochondria have, next to their function in respiration, an important role in the apoptotic-signaling pathway. Malfunctioning at any level of the cell is eventually translated in the release of apoptogenic factors from the mitochondrial intermembrane space resulting in the organized demise of the cell. Some of these factors, such as AIF and endonuclease G, appear to be highly conserved during evolution. Other factors, like cytochrome c, have gained their apoptogenic function later during evolution. In this review, we focus on the role of cytochrome c, AIF, endonuclease G, Smac/DIABLO, Omi/HtrA2, Acyl-CoA-binding protein, and polypyrimidine tract-binding protein in the initiation and modulation of cell death in different model organisms. These mitochondrial factors may contribute to both caspase-dependent and caspase-independent processes in apoptotic cell death.
Brown, Guy C. “Mitochondria and cell death.” Biochemist 27 (2005): 15-18.
GORLIN, RICHARD. “Pathophysiology of cardiac pain.” Circulation 32.1 (1965): 138-148.
Know, Lee. Mitochondria and the future of medicine: the key to understanding disease, chronic illness, aging, and life itself. Chelsea green publishing, 2018.
Boyd, Eldon M., Irene Godi, and M. Abel. “Acute oral toxicity of sucrose.” Toxicology and Applied Pharmacology 7.4 (1965): 609-618.
Higginson, J. “Rethinking the environmental causation of human cancer.” Food and Cosmetics Toxicology 19 (1981): 539-548.
Kearns, Cristin E., Dorie Apollonio, and Stanton A. Glantz. “Sugar industry sponsorship of germ-free rodent studies linking sucrose to hyperlipidemia and cancer: an historical analysis of internal documents.” PLoS biology 15.11 (2017): e2003460.
Kearns, Cristin E., Laura A. Schmidt, and Stanton A. Glantz. “Sugar industry and coronary heart disease research: a historical analysis of internal industry documents.” JAMA internal medicine 176.11 (2016): 1680-1685.
Taubes G. The case against sugar. New York, Alfred A. Knopf. 2016.
Seely, Stephen, and David F. Horrobin. “Diet and breast cancer: the possible connection with sugar consumption.” Medical hypotheses 11.3 (1983): 319-327.
MOERMAN, CLARA J., H. BAS DE MESQUITA, and SYTSKE RUNIA. “Dietary sugar intake in the aetiology of biliary tract cancer.” International journal of epidemiology 22.2 (1993): 207-214.
Bostick, Roberd M., et al. “Sugar, meat, and fat intake, and non-dietary risk factors for colon cancer incidence in Iowa women (United States).” Cancer Causes & Control 5 (1994): 38-52.
Michaud, Dominique S., et al. “Dietary sugar, glycemic load, and pancreatic cancer risk in a prospective study.” Journal of the National Cancer Institute 94.17 (2002): 1293-1300.
Bradshaw, Patrick T., et al. “Consumption of sweet foods and breast cancer risk: a case–control study of women on Long Island, New York.” Cancer causes & control 20 (2009): 1509-1515.
Genkinger, Jeanine M., et al. “Coffee, tea, and sugar-sweetened carbonated soft drink intake and pancreatic cancer risk: a pooled analysis of 14 cohort studies.” Cancer epidemiology, biomarkers & prevention 21.2 (2012): 305-318.
Jiang, Yan, et al. “A sucrose-enriched diet promotes tumorigenesis in mammary gland in part through the 12-lipoxygenase pathway.” Cancer research 76.1 (2016): 24-29.
Peeters, Ken, et al. “Fructose-1, 6-bisphosphate couples glycolytic flux to activation of Ras.” Nature communications 8.1 (2017): 922.
Yoshida, Yilin, and Eduardo J. Simoes. “Sugar-sweetened beverage, obesity, and type 2 diabetes in children and adolescents: policies, taxation, and programs.” Current diabetes reports 18 (2018): 1-10.
Calle, Eugenia E., et al. “Overweight, obesity, and mortality from cancer in a prospectively studied cohort of US adults.” New England Journal of Medicine 348.17 (2003): 1625-1638./a>
Jiralerspong, Sao, and Pamela J. Goodwin. “Obesity and breast cancer prognosis: evidence, challenges, and opportunities.” Journal of Clinical Oncology 34.35 (2016): 4203-4216.
Goodwin PJ, Chlebowski RT. Obesity and Cancer: Insights for Clinicians. J Clin Oncol. 2016 Dec 10;34(35):4197-4202. doi: 10.1200/JCO.2016.70.5327. Epub 2016 Nov 7. PMID: 27903158; PMCID: PMC5455321.
Elizabeth K. Ely, Stephanie M. Gruss, Elizabeth T. Luman, Edward W. Gregg, Mohammed K. Ali, Kunthea Nhim, Deborah B. Rolka, Ann L. Albright; A National Effort to Prevent Type 2 Diabetes: Participant-Level Evaluation of CDC’s National Diabetes Prevention Program. Diabetes Care 1 October 2017; 40 (10): 1331–1341. https://doi.org/10.2337/dc16-2099
Giovannucci, Edward, et al. “Diabetes and cancer: a consensus report.” CA: a cancer journal for clinicians 60.4 (2010): 207-221.
Suping Ling, Karen Brown, Joanne K. Miksza, Lynne M. Howells, Amy Morrison, Eyad Issa, Thomas Yates, Kamlesh Khunti, Melanie J. Davies, Francesco Zaccardi,
Risk of cancer incidence and mortality associated with diabetes: A systematic review with trend analysis of 203 cohorts,
Nutrition, Metabolism and Cardiovascular Diseases,
Volume 31, Issue 1, 2021, Pages 14-22, ISSN 0939-4753,
https://doi.org/10.1016/j.numecd.2020.09.023.
(https://www.sciencedirect.com/science/article/pii/S0939475320304105)
Abstract: Aim Whether the relative risk of cancer incidence and mortality associated with diabetes has changed over time is unknown. Data synthesis On August 12th, 2020, we electronically searched for observational studies reporting on the association between diabetes and cancer. We estimated temporal trends in the relative risk of cancer incidence or mortality associated with diabetes and calculated the ratio of relative risk (RRR) comparing different periods. As many as 193 eligible articles, reporting data on 203 cohorts (56,852,381 participants; 3,735,564 incident cancer cases; 185,404 cancer deaths) and covering the period 1951–2013, were included. The relative risk of all–site cancer incidence increased between 1980 and 2000 [RRR 1990 vs.1980: (1.24; 95% CI: 1.16, 1.34); 2000 vs.1990: (1.23; 1.15, 1.31)] and stabilised thereafter at a relative risk of 1.2; the relative risk of all–site cancer mortality was constant at about 1.2 from 1980 to 2010. Both magnitudes and trends in relative risk varied across cancer sites: the relative risk of colorectal, female breast, and endometrial cancer incidence and pancreatic cancer mortality was constant during the observed years; it increased for bladder, stomach, kidney, and pancreatic cancer incidence until 2000; and decreased for liver while increased for prostate, colon and gallbladder cancer incidence after 2000. Conclusions Alongside the increasing prevalence of diabetes, the temporal patterns of the relative risk of cancer associated with diabetes may have contributed to the current burden of cancer in people with diabetes.
Crawley, Danielle J., et al. “Serum glucose and risk of cancer: a meta-analysis.” BMC cancer 14 (2014): 1-11.
Gunter, Marc J., et al. “Breast cancer risk in metabolically healthy but overweight postmenopausal women.” Cancer research 75.2 (2015): 270-274.
Gunter, Marc J., et al. “Insulin, insulin-like growth factor-I, and risk of breast cancer in postmenopausal women.” Journal of the National Cancer Institute 101.1 (2009): 48-60.
Pal, Aparna, et al. “PTEN mutations as a cause of constitutive insulin sensitivity and obesity.” New England Journal of Medicine 367.11 (2012): 1002-1011.
Bowker, Samantha L., et al. “Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin.” Diabetes care 29.2 (2006): 254-258.
Currie, Craig John, Christopher David Poole, and E. A. M. Gale. “The influence of glucose-lowering therapies on cancer risk in type 2 diabetes.” Diabetologia 52 (2009): 1766-1777. TEKST
Frasca, F., et al. “Insulin receptor isoform A, a newly recognized, high-affinity insulin-like growth factor II receptor in fetal and cancer cells.” Molecular and cellular biology 19.5 (1999): 3278-3288.
Malaguarnera, Roberta, and Antonino Belfiore. “The insulin receptor: a new target for cancer therapy.” Frontiers in endocrinology 2 (2011): 93.
Vigneri, R., I. D. Goldfine, and L. J. J. O. E. I. Frittitta. “Insulin, insulin receptors, and cancer.” Journal of endocrinological investigation 39 (2016): 1365-1376.
Schulze, Matthias B., et al. “Dietary pattern, inflammation, and incidence of type 2 diabetes in women–.” The American journal of clinical nutrition 82.3 (2005): 675-684.
Aeberli, Isabelle, et al. “Low to moderate sugar-sweetened beverage consumption impairs glucose and lipid metabolism and promotes inflammation in healthy young men: a randomized controlled trial.” The American journal of clinical nutrition 94.2 (2011): 479-485.
Frazier, Thomas H., John K. DiBaise, and Craig J. McClain. “Gut microbiota, intestinal permeability, obesity‐induced inflammation, and liver injury.” Journal of Parenteral and Enteral Nutrition 35 (2011): 14S-20S.
Bruun, J. M., et al. “Consumption of sucrose-sweetened soft drinks increases plasma levels of uric acid in overweight and obese subjects: a 6-month randomised controlled trial.” European journal of clinical nutrition 69.8 (2015): 949-953.
Jameel, Faizan, et al. “Acute effects of feeding fructose, glucose and sucrose on blood lipid levels and systemic inflammation.” Lipids in health and disease 13.1 (2014): 1-7.
Hert, Kerrie A., et al. “Decreased consumption of sugar-sweetened beverages improved selected biomarkers of chronic disease risk among US adults: 1999 to 2010.” Nutrition Research 34.1 (2014): 58-65.
Spreadbury, Ian. “Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity.” Diabetes, metabolic syndrome and obesity: targets and therapy (2012): 175-189.
Buyken AE, Flood V, Empson M, Rochtchina E, Barclay AW, Brand-Miller J, Mitchell P. Carbohydrate nutrition and inflammatory disease mortality in older adults. Am J Clin Nutr. 2010 Sep;92(3):634-43. doi: 10.3945/ajcn.2010.29390. Epub 2010 Jun 23. PMID: 20573797.
Thoudam T, Jeon JH, Ha CM, Lee IK. Role of Mitochondria-Associated Endoplasmic Reticulum Membrane in Inflammation-Mediated Metabolic Diseases. Mediators Inflamm. 2016;2016:1851420. doi: 10.1155/2016/1851420. Epub 2016 Dec 15. PMID: 28074080; PMCID: PMC5198184.
Casqueiro J, Casqueiro J, Alves C. Infections in patients with diabetes mellitus: A review of pathogenesis. Indian J Endocrinol Metab. 2012 Mar;16 Suppl 1(Suppl1):S27-36. doi: 10.4103/2230-8210.94253. PMID: 22701840; PMCID: PMC3354930.
Beck-Nielsen H, Pedersen O, Lindskov HO. Impaired cellular insulin binding and insulin sensitivity induced by high-fructose feeding in normal subjects. Am J Clin Nutr. 1980 Feb;33(2):273-8. doi: 10.1093/ajcn/33.2.273. PMID: 6986758.
Stanhope KL, Schwarz JM, Keim NL, Griffen SC, Bremer AA, Graham JL, Hatcher B, Cox CL, Dyachenko A, Zhang W, McGahan JP, Seibert A, Krauss RM, Chiu S, Schaefer EJ, Ai M, Otokozawa S, Nakajima K, Nakano T, Beysen C, Hellerstein MK, Berglund L, Havel PJ. Consuming fructose-sweetened, not glucose-sweetened, beverages increases visceral adiposity and lipids and decreases insulin sensitivity in overweight/obese humans. J Clin Invest. 2009 May;119(5):1322-34. doi: 10.1172/JCI37385. Epub 2009 Apr 20. PMID: 19381015; PMCID: PMC2673878.
Delli Bovi AP, Di Michele L, Laino G, Vajro P. Obesity and Obesity Related Diseases, Sugar Consumption and Bad Oral Health: A Fatal Epidemic Mixtures: The Pediatric and Odontologist Point of View. Transl Med UniSa. 2017 Jul 1;16:11-16. PMID: 28775964; PMCID: PMC5536157.
LeRoith D, Roberts CT Jr. The insulin-like growth factor system and cancer. Cancer Lett. 2003 Jun 10;195(2):127-37. doi: 10.1016/s0304-3835(03)00159-9. PMID: 12767520.
Renehan AG, Zwahlen M, Minder C, O’Dwyer ST, Shalet SM, Egger M. Insulin-like growth factor (IGF)-I, IGF binding protein-3, and cancer risk: systematic review and meta-regression analysis. Lancet. 2004 Apr 24;363(9418):1346-53. doi: 10.1016/S0140-6736(04)16044-3. PMID: 15110491.
Cioffi F, Senese R, Lasala P, Ziello A, Mazzoli A, Crescenzo R, Liverini G, Lanni A, Goglia F, Iossa S. Fructose-Rich Diet Affects Mitochondrial DNA Damage and Repair in Rats. Nutrients. 2017 Mar 24;9(4):323. doi: 10.3390/nu9040323. PMID: 28338610; PMCID: PMC5409662.
Liu H, Huang D, McArthur DL, Boros LG, Nissen N, Heaney AP. Fructose induces transketolase flux to promote pancreatic cancer growth. Cancer Res. 2010 Aug 1;70(15):6368-76. doi: 10.1158/0008-5472.CAN-09-4615. Epub 2010 Jul 20. PMID: 20647326.
Ozawa T, Maehara N, Kai T, Arai S, Miyazaki T. Dietary fructose-induced hepatocellular carcinoma development manifested in mice lacking apoptosis inhibitor of macrophage (AIM). Genes Cells. 2016 Dec;21(12):1320-1332. doi: 10.1111/gtc.12446. Epub 2016 Nov 4. PMID: 27813205.
Li J, Lin W, Zhuang L. CD5L-induced activation of autophagy is associated with hepatoprotection in ischemic reperfusion injury via the CD36/ATG7 axis. Exp Ther Med. 2020 Apr;19(4):2588-2596. doi: 10.3892/etm.2020.8497. Epub 2020 Feb 7. PMID: 32256738; PMCID: PMC7086238.
Allen BG, Bhatia SK, Anderson CM, Eichenberger-Gilmore JM, Sibenaller ZA, Mapuskar KA, Schoenfeld JD, Buatti JM, Spitz DR, Fath MA. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014;2:963-70. doi: 10.1016/j.redox.2014.08.002. Epub 2014 Aug 7. PMID: 25460731; PMCID: PMC4215472.
Fine EJ, Feinman RD. Insulin, carbohydrate restriction, metabolic syndrome and cancer. Expert Rev Endocrinol Metab. 2015 Jan;10(1):15-24. doi: 10.1586/17446651.2014.960392. Epub 2014 Sep 22. PMID: 30289045.
Winter SF, Loebel F, Dietrich J. Role of ketogenic metabolic therapy in malignant glioma: A systematic review. Crit Rev Oncol Hematol. 2017 Apr;112:41-58. doi: 10.1016/j.critrevonc.2017.02.016. Epub 2017 Feb 20. PMID: 28325264.
Barañano KW, Hartman AL. The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol. 2008 Nov;10(6):410-9. doi: 10.1007/s11940-008-0043-8. PMID: 18990309; PMCID: PMC2898565.
Freeman JM, Vining EP, Kossoff EH, Pyzik PL, Ye X, Goodman SN. A blinded, crossover study of the efficacy of the ketogenic diet. Epilepsia. 2009 Feb;50(2):322-5. doi: 10.1111/j.1528-1167.2008.01740.x. Epub 2008 Aug 19. PMID: 18717710.
Lambrechts DA, de Kinderen RJ, Vles JS, de Louw AJ, Aldenkamp AP, Majoie HJ. A randomized controlled trial of the ketogenic diet in refractory childhood epilepsy. Acta Neurol Scand. 2017 Feb;135(2):231-239. doi: 10.1111/ane.12592. Epub 2016 Mar 29. PMID: 27027847.
Dyson PA, Beatty S, Matthews DR. A low-carbohydrate diet is more effective in reducing body weight than healthy eating in both diabetic and non-diabetic subjects. Diabet Med. 2007 Dec;24(12):1430-5. doi: 10.1111/j.1464-5491.2007.02290.x. Epub 2007 Oct 29. PMID: 17971178.
Westman EC, Yancy WS Jr, Mavropoulos JC, Marquart M, McDuffie JR. The effect of a low-carbohydrate, ketogenic diet versus a low-glycemic index diet on glycemic control in type 2 diabetes mellitus. Nutr Metab (Lond). 2008 Dec 19;5:36. doi: 10.1186/1743-7075-5-36. PMID: 19099589; PMCID: PMC2633336.
Johnstone AM, Horgan GW, Murison SD, Bremner DM, Lobley GE. Effects of a high-protein ketogenic diet on hunger, appetite, and weight loss in obese men feeding ad libitum. Am J Clin Nutr. 2008 Jan;87(1):44-55. doi: 10.1093/ajcn/87.1.44. PMID: 18175736.
Sumithran P, Prendergast LA, Delbridge E, Purcell K, Shulkes A, Kriketos A, Proietto J. Ketosis and appetite-mediating nutrients and hormones after weight loss. Eur J Clin Nutr. 2013 Jul;67(7):759-64. doi: 10.1038/ejcn.2013.90. Epub 2013 May 1. PMID: 23632752.
McPherson PA, McEneny J. The biochemistry of ketogenesis and its role in weight management, neurological disease and oxidative stress. J Physiol Biochem. 2012 Mar;68(1):141-51. doi: 10.1007/s13105-011-0112-4. Epub 2011 Oct 8. PMID: 21983804.
Gasior M, Rogawski MA, Hartman AL. Neuroprotective and disease-modifying effects of the ketogenic diet. Behav Pharmacol. 2006 Sep;17(5-6):431-9. doi: 10.1097/00008877-200609000-00009. PMID: 16940764; PMCID: PMC2367001.
Moore J. Keto Clarity. Victoria Belt Publishing. 20145 58.
Dashti HM, Mathew TC, Hussein T, Asfar SK, Behbahani A, Khoursheed MA, Al-Sayer HM, Bo-Abbas YY, Al-Zaid NS. Long-term effects of a ketogenic diet in obese patients. Exp Clin Cardiol. 2004 Fall;9(3):200-5. PMID: 19641727; PMCID: PMC2716748.
Coppola G, D’Aniello A, Messana T, Di Pasquale F, della Corte R, Pascotto A, Verrotti A. Low glycemic index diet in children and young adults with refractory epilepsy: first Italian experience. Seizure. 2011 Sep;20(7):526-8. doi: 10.1016/j.seizure.2011.03.008. Epub 2011 Apr 13. PMID: 21489826.
Chang HT, Olson LK, Schwartz KA. Ketolytic and glycolytic enzymatic expression profiles in malignant gliomas: implication for ketogenic diet therapy. Nutr Metab (Lond). 2013 Jul 5;10(1):47. doi: 10.1186/1743-7075-10-47. PMID: 23829383; PMCID: PMC3707813.
Belfiore A, Malaguarnera R. Insulin receptor and cancer. Endocr Relat Cancer. 2011 Jul 4;18(4):R125-47. doi: 10.1530/ERC-11-0074. PMID: 21606157.
Klement, R. J., and M. K. Fink. “Dietary and pharmacological modification of the insulin/IGF-1 system: exploiting the full repertoire against cancer.” Oncogenesis 5.2 (2016): e193-e193.
Poff, Ari M., et al. “Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer.” International journal of cancer 135.7 (2014): 1711-1720.
Tan-Shalaby, J.L., Carrick, J., Edinger, K. et al. Modified Atkins diet in advanced malignancies – final results of a safety and feasibility trial within the Veterans Affairs Pittsburgh Healthcare System. Nutr Metab (Lond) 13, 52 (2016). https://doi.org/10.1186/s12986-016-0113-y
Moen, Ingrid, and Linda EB Stuhr. “Hyperbaric oxygen therapy and cancer—a review.” Targeted oncology 7 (2012): 233-242.
Minimal Residual Disease–Guided Intermittent Dosing in Patients With Cancer: Successful Treatment of Chemoresistant Anaplastic Large Cell Lymphoma Using Intermittent Lorlatinib Dosing | JCO Precision Oncology
Weber, Daniela D., et al. “Ketogenic diet in the treatment of cancer–where do we stand?.” Molecular metabolism 33 (2020): 102-121.
Cobo, Nicole H., et al. “The ketogenic diet as broad-spectrum treatment for super-refractory pediatric status epilepticus: challenges in implementation in the pediatric and neonatal intensive care units.” Journal of Child Neurology 30.2 (2015): 259-266.
Gupta, L., et al. “Ketogenic diet in endocrine disorders: Current perspectives.” Journal of postgraduate medicine 63.4 (2017): 242.
Klement, Rainer J., et al. “Anti-tumor effects of ketogenic diets in mice: a meta-analysis.” PLoS One 11.5 (2016): e0155050.
Li, Jing, Haiyan Zhang, and Zhu Dai. “Cancer treatment with the ketogenic diet: a systematic review and meta-analysis of animal studies.” Frontiers in Nutrition 8 (2021): 594408.
Poff, Angela M., et al. “The ketogenic diet and hyperbaric oxygen therapy prolong survival in mice with systemic metastatic cancer.” PloS one 8.6 (2013): e65522.
Lv, Mengmeng, et al. “Roles of caloric restriction, ketogenic diet and intermittent fasting during initiation, progression and metastasis of cancer in animal models: a systematic review and meta-analysis.” PloS one 9.12 (2014): e115147.
Weiser, Mary Ann, et al. “Relation between the duration of remission and hyperglycemia during induction chemotherapy for acute lymphocytic leukemia with a hyperfractionated cyclophosphamide, vincristine, doxorubicin, and dexamethasone/methotrexate–cytarabine regimen.” Cancer: Interdisciplinary International Journal of the American Cancer Society 100.6 (2004): 1179-1185.
McGirt, Matthew J., et al. “Persistent outpatient hyperglycemia is independently associated with decreased survival after primary resection of malignant brain astrocytomas.” Neurosurgery 63.2 (2008): 286-291.
Derr, Rachel L., et al. “Association between hyperglycemia and survival in patients with newly diagnosed glioblastoma.” Journal of clinical oncology 27.7 (2009): 1082.
Lamkin, Donald M., et al. “Glucose as a prognostic factor in ovarian carcinoma.” Cancer: Interdisciplinary International Journal of the American Cancer Society 115.5 (2009): 1021-1027.
P. Sanpaolo, V. Barbieri, D. Genovesi,
Prognostic value of breast cancer subtypes on breast cancer specific survival, distant metastases and local relapse rates in conservatively managed early stage breast cancer: A retrospective clinical study, European Journal of Surgical Oncology (EJSO), Volume 37, Issue 10, 2011, Pages 876-882, ISSN 0748-7983, https://doi.org/10.1016/j.ejso.2011.07.001.
Villarreal-Garza, Cynthia, et al. “Impact of diabetes and hyperglycemia on survival in advanced breast cancer patients.” Experimental diabetes research 2012 (2012).
Minicozzi, Pamela, et al. “High fasting blood glucose and obesity significantly and independently increase risk of breast cancer death in hormone receptor-positive disease.” European journal of cancer 49.18 (2013): 3881-3888.
Mayer, Arnulf, et al. “Strong adverse prognostic impact of hyperglycemic episodes during adjuvant chemoradiotherapy of glioblastoma multiforme.” Strahlentherapie und Onkologie 190.10 (2014): 933.
Tieu, Minh Thi, et al. “Impact of glycemia on survival of glioblastoma patients treated with radiation and temozolomide.” Journal of neuro-oncology 124 (2015): 119-126.
Monzavi-Karbassi, Behjatolah, et al. “Pre-diagnosis blood glucose and prognosis in women with breast cancer.” Cancer & metabolism 4.1 (2016): 1-6.
Adeberg, Sebastian, et al. “The influence of hyperglycemia during radiotherapy on survival in patients with primary glioblastoma.” Acta Oncologica 55.2 (2016): 201-207.
Klement, Rainer Johannes. “Wilhelm Brünings’ forgotten contribution to the metabolic treatment of cancer utilizing hypoglycemia and a very low carbohydrate (ketogenic) diet.” Journal of traditional and Complementary Medicine 9.3 (2019): 192-200.
Klement, Rainer Johannes. “Fasting, fats, and physics: combining ketogenic and radiation therapy against cancer.” Complementary medicine research 25.2 (2018): 102-113.
Nebeling, Linda C., et al. “Effects of a Ketogenic Diet on Tumor Metabolism and Nutritional Status in Pediatric Oncology Patients: Two.” Journal of the American College of Nutrition 14.2 (1995): 202-208.
Fine, Eugene J., et al. “Targeting insulin inhibition as a metabolic therapy in advanced cancer: a pilot safety and feasibility dietary trial in 10 patients.” Nutrition 28.10 (2012): 1028-1035.
Schroeder, U., et al. “Decline of lactate in tumor tissue after ketogenic diet: in vivo microdialysis study in patients with head and neck cancer.” Nutrition and cancer 65.6 (2013): 843-849.
Lane, Jordin, et al. “Ketogenic diet for cancer: critical assessment and research recommendations.” Nutrients 13.10 (2021): 3562.
Vergati, Matteo, et al. “Ketogenic diet and other dietary intervention strategies in the treatment of cancer.” Current medicinal chemistry 24.12 (2017): 1170-1185.
Klement, Rainer J., et al. “Application of Bayesian evidence synthesis to modelling the effect of ketogenic therapy on survival of high grade glioma patients.” Theoretical Biology and Medical Modelling 15 (2018): 1-15.
Abdelwahab, Mohammed G., et al. “The ketogenic diet is an effective adjuvant to radiation therapy for the treatment of malignant glioma.” PloS one 7.5 (2012): e36197.
Allen, Bryan G., et al. “Ketogenic diets enhance oxidative stress and radio-chemo-therapy responses in lung cancer xenografts.” Clinical Cancer Research 19.14 (2013): 3905-3913.
Klement, Rainer J. “Restricting carbohydrates to fight head and neck cancer—is this realistic?.” Cancer biology & medicine 11.3 (2014): 145.
Allen, Bryan G., et al. “Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism.” Redox biology 2 (2014): 963-970.
Klement, Rainer J., and Colin E. Champ. “Calories, carbohydrates, and cancer therapy with radiation: exploiting the five R’s through dietary manipulation.” Cancer and Metastasis Reviews 33.1 (2014): 217-229.
Sherwin, R. S., R. G. Hendler, and P. Felig. “Effect of ketone infusions on amino acid and nitrogen metabolism in man.” The Journal of clinical investigation 55.6 (1975): 1382-1390.
Weill, Pierre, et al. “Effects of introducing linseed in livestock diet on blood fatty acid composition of consumers of animal products.” Annals of Nutrition and Metabolism 46.5 (2002): 182-191.
BARBER, Matthew D., et al. “Metabolic response to feeding in weight-losing pancreatic cancer patients and its modulation by a fish-oil-enriched nutritional supplement.” Clinical Science 98.4 (2000): 389-399.
Zuccoli, Giulio, et al. “Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report.” Nutrition & metabolism 7.1 (2010): 1-7.
Zuccoli, Giulio, et al. “Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report.” Nutrition & metabolism 7.1 (2010): 1-7.
Klement, Rainer J., and Reinhart A. Sweeney. “Impact of a ketogenic diet intervention during radiotherapy on body composition: I. Initial clinical experience with six prospectively studied patients.” BMC research notes 9 (2016): 1-13.
Khodabakhshi, Adeleh, et al. “Effects of Ketogenic metabolic therapy on patients with breast cancer: A randomized controlled clinical trial.” Clinical Nutrition 40.3 (2021): 751-758.
Tisdale, M. J., R. A. Brennan, and K. C. Fearon. “Reduction of weight loss and tumour size in a cachexia model by a high fat diet.” British journal of cancer 56.1 (1987): 39-43.
Meyer, Christian, et al. “Renal substrate exchange and gluconeogenesis in normal postabsorptive humans.” American Journal of Physiology-Endocrinology and Metabolism 282.2 (2002): E428-E434.
Watson, Naomi, Thomas J. McClelland, and Zudin Puthucheary. “Is there a role for ketones as alternative fuel in critical illness?.” Current Opinion in Critical Care (2023): 10-1097.
Fearon KC, Borland W, Preston T, Tisdale MJ, Shenkin A, Calman KC. Cancer cachexia: influence of systemic ketosis on substrate levels and nitrogen metabolism. Am J Clin Nutr. 1988 Jan;47(1):42-8. doi: 10.1093/ajcn/47.1.42. PMID: 3122552.
Nair KS, Welle SL, Halliday D, Campbell RG. Effect of beta-hydroxybutyrate on whole-body leucine kinetics and fractional mixed skeletal muscle protein synthesis in humans. J Clin Invest. 1988 Jul;82(1):198-205. doi: 10.1172/JCI113570. PMID: 3392207; PMCID: PMC303494.
Simopoulos AP. The importance of the ratio of omega-6/omega-3 essential fatty acids. Biomed Pharmacother. 2002 Oct;56(8):365-79. doi: 10.1016/s0753-3322(02)00253-6. PMID: 12442909.
Tedde R, Sechi LA, Marigliano A, Pala A, Scano L. Antihypertensive effect of insulin reduction in diabetic-hypertensive patients. Am J Hypertens. 1989 Mar;2(3 Pt 1):163-70. doi: 10.1093/ajh/2.3.163. PMID: 2645915.
Persson SU. Blood pressure reactions to insulin treatment in patients with type 2 diabetes. Int J Angiol. 2007 Winter;16(4):135-8. doi: 10.1055/s-0031-1278267. PMID: 22477329; PMCID: PMC2733033.
Brands MW, Manhiani MM. Sodium-retaining effect of insulin in diabetes. Am J Physiol Regul Integr Comp Physiol. 2012 Dec;303(11):R1101-9. doi: 10.1152/ajpregu.00390.2012. Epub 2012 Oct 3. PMID: 23034715; PMCID: PMC3533616.
DeFronzo RA. The effect of insulin on renal sodium metabolism. A review with clinical implications. Diabetologia. 1981 Sep;21(3):165-71. doi: 10.1007/BF00252649. PMID: 7028550.
De Lorenzo MS, Baljinnyam E, Vatner DE, Abarzúa P, Vatner SF, Rabson AB. Caloric restriction reduces growth of mammary tumors and metastases. Carcinogenesis. 2011 Sep;32(9):1381-7. doi: 10.1093/carcin/bgr107. Epub 2011 Jun 10. PMID: 21665891; PMCID: PMC3165123.
Sheldon WG, Bucci TJ, Hart RW, Turturro A. Age-related neoplasia in a lifetime study of ad libitum-fed and food-restricted B6C3F1 mice. Toxicol Pathol. 1995 Jul-Aug;23(4):458-76. doi: 10.1177/019262339502300403. PMID: 7501958.
Johnstone AM, Faber P, Gibney ER, Elia M, Horgan G, Golden BE, Stubbs RJ. Effect of an acute fast on energy compensation and feeding behaviour in lean men and women. Int J Obes Relat Metab Disord. 2002 Dec;26(12):1623-8. doi: 10.1038/sj.ijo.0802151. PMID: 12461679.
Marinac CR, Nelson SH, Breen CI, Hartman SJ, Natarajan L, Pierce JP, Flatt SW, Sears DD, Patterson RE. Prolonged Nightly Fasting and Breast Cancer Prognosis. JAMA Oncol. 2016 Aug 1;2(8):1049-55. doi: 10.1001/jamaoncol.2016.0164. PMID: 27032109; PMCID: PMC4982776.
Doyle C, Kushi LH, Byers T, Courneya KS, Demark-Wahnefried W, Grant B, McTiernan A, Rock CL, Thompson C, Gansler T, Andrews KS; 2006 Nutrition, Physical Activity and Cancer Survivorship Advisory Committee; American Cancer Society. Nutrition and physical activity during and after cancer treatment: an American Cancer Society guide for informed choices. CA Cancer J Clin. 2006 Nov-Dec;56(6):323-53. doi: 10.3322/canjclin.56.6.323. PMID: 17135691.
Mulrooney TJ, Marsh J, Urits I, Seyfried TN, Mukherjee P. Influence of caloric restriction on constitutive expression of NF-κB in an experimental mouse astrocytoma. PLoS One. 2011 Mar 30;6(3):e18085. doi: 10.1371/journal.pone.0018085. PMID: 21479220; PMCID: PMC3068150.
Zauner C, Schneeweiss B, Kranz A, Madl C, Ratheiser K, Kramer L, Roth E, Schneider B, Lenz K. Resting energy expenditure in short-term starvation is increased as a result of an increase in serum norepinephrine. Am J Clin Nutr. 2000 Jun;71(6):1511-5. doi: 10.1093/ajcn/71.6.1511. PMID: 10837292.
Heilbronn LK, Smith SR, Martin CK, Anton SD, Ravussin E. Alternate-day fasting in nonobese subjects: effects on body weight, body composition, and energy metabolism. Am J Clin Nutr. 2005 Jan;81(1):69-73. doi: 10.1093/ajcn/81.1.69. PMID: 15640462.
Puchalska P, Crawford PA. Multi-dimensional Roles of Ketone Bodies in Fuel Metabolism, Signaling, and Therapeutics. Cell Metab. 2017 Feb 7;25(2):262-284. doi: 10.1016/j.cmet.2016.12.022. PMID: 28178565; PMCID: PMC5313038.
Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, Allison DB, Cruzen C, Simmons HA, Kemnitz JW, Weindruch R. Caloric restriction delays disease onset and mortality in rhesus monkeys. Science. 2009 Jul 10;325(5937):201-4. doi: 10.1126/science.1173635. PMID: 19590001; PMCID: PMC2812811.
Weindruch R, Walford RL. Dietary restriction in mice beginning at 1 year of age: effect on life-span and spontaneous cancer incidence. Science. 1982 Mar 12;215(4538):1415-8. doi: 10.1126/science.7063854. PMID: 7063854.
Kerndt PR, Naughton JL, Driscoll CE, Loxterkamp DA. Fasting: the history, pathophysiology and complications. West J Med. 1982 Nov;137(5):379-99. PMID: 6758355; PMCID: PMC1274154.
Thissen JP, Ketelslegers JM, Underwood LE. Nutritional regulation of the insulin-like growth factors. Endocr Rev. 1994 Feb;15(1):80-101. doi: 10.1210/edrv-15-1-80. PMID: 8156941.
Fontana L, Partridge L, Longo VD. Extending healthy life span–from yeast to humans. Science. 2010 Apr 16;328(5976):321-6. doi: 10.1126/science.1172539. PMID: 20395504; PMCID: PMC3607354.
Safdie F, Brandhorst S, Wei M, Wang W, Lee C, Hwang S, Conti PS, Chen TC, Longo VD. Fasting enhances the response of glioma to chemo- and radiotherapy. PLoS One. 2012;7(9):e44603. doi: 10.1371/journal.pone.0044603. Epub 2012 Sep 11. PMID: 22984531; PMCID: PMC3439413.
Bauersfeld SP, Kessler CS, Wischnewsky M, Jaensch A, Steckhan N, Stange R, Kunz B, Brückner B, Sehouli J, Michalsen A. The effects of short-term fasting on quality of life and tolerance to chemotherapy in patients with breast and ovarian cancer: a randomized cross-over pilot study. BMC Cancer. 2018 Apr 27;18(1):476. doi: 10.1186/s12885-018-4353-2. PMID: 29699509; PMCID: PMC5921787.
Hine C, Mitchell JR. Saying no to drugs: fasting protects hematopoietic stem cells from chemotherapy and aging. Cell Stem Cell. 2014 Jun 5;14(6):704-5. doi: 10.1016/j.stem.2014.05.016. PMID: 24905161; PMCID: PMC4278638.
Bishop NA, Guarente L. Genetic links between diet and lifespan: shared mechanisms from yeast to humans. Nat Rev Genet. 2007 Nov;8(11):835-44. doi: 10.1038/nrg2188. PMID: 17909538.
Jin S, White E. Role of autophagy in cancer: management of metabolic stress. Autophagy. 2007 Jan-Feb;3(1):28-31. doi: 10.4161/auto.3269. Epub 2007 Jan 3. PMID: 16969128; PMCID: PMC2770734.
Faris MA, Kacimi S, Al-Kurd RA, Fararjeh MA, Bustanji YK, Mohammad MK, Salem ML. Intermittent fasting during Ramadan attenuates proinflammatory cytokines and immune cells in healthy subjects. Nutr Res. 2012 Dec;32(12):947-55. doi: 10.1016/j.nutres.2012.06.021. Epub 2012 Oct 4. PMID: 23244540.
Longo VD, Mattson MP. Fasting: molecular mechanisms and clinical applications. Cell Metab. 2014 Feb 4;19(2):181-92. doi: 10.1016/j.cmet.2013.12.008. Epub 2014 Jan 16. PMID: 24440038; PMCID: PMC3946160.
Wijngaarden MA, van der Zon GC, van Dijk KW, Pijl H, Guigas B. Effects of prolonged fasting on AMPK signaling, gene expression, and mitochondrial respiratory chain content in skeletal muscle from lean and obese individuals. Am J Physiol Endocrinol Metab. 2013 May 1;304(9):E1012-21. doi: 10.1152/ajpendo.00008.2013. Epub 2013 Mar 19. PMID: 23512807.
Lee C, Raffaghello L, Brandhorst S, Safdie FM, Bianchi G, Martin-Montalvo A, Pistoia V, Wei M, Hwang S, Merlino A, Emionite L, de Cabo R, Longo VD. Fasting cycles retard growth of tumors and sensitize a range of cancer cell types to chemotherapy. Sci Transl Med. 2012 Mar 7;4(124):124ra27. doi: 10.1126/scitranslmed.3003293. Epub 2012 Feb 8. PMID: 22323820; PMCID: PMC3608686.
Raffaghello L, Lee C, Safdie FM, Wei M, Madia F, Bianchi G, Longo VD. Starvation-dependent differential stress resistance protects normal but not cancer cells against high-dose chemotherapy. Proc Natl Acad Sci U S A. 2008 Jun 17;105(24):8215-20. doi: 10.1073/pnas.0708100105. Epub 2008 Mar 31. PMID: 18378900; PMCID: PMC2448817.
Laviano A, Rossi Fanelli F. Toxicity in chemotherapy–when less is more. N Engl J Med. 2012 Jun 14;366(24):2319-20. doi: 10.1056/NEJMcibr1202395. PMID: 22694004.
Maccario M, Aimaretti G, Grottoli S, Gauna C, Tassone F, Corneli G, Rossetto R, Wu Z, Strasburger CJ, Ghigo E. Effects of 36 hour fasting on GH/IGF-I axis and metabolic parameters in patients with simple obesity. Comparison with normal subjects and hypopituitary patients with severe GH deficiency. Int J Obes Relat Metab Disord. 2001 Aug;25(8):1233-9. doi: 10.1038/sj.ijo.0801671. PMID: 11477509.
Bergman BC, Cornier MA, Horton TJ, Bessesen DH. Effects of fasting on insulin action and glucose kinetics in lean and obese men and women. Am J Physiol Endocrinol Metab. 2007 Oct;293(4):E1103-11. doi: 10.1152/ajpendo.00613.2006. Epub 2007 Aug 7. PMID: 17684102.
Brandhorst S. Fasting and fasting-mimicking diets for chemotherapy augmentation. Geroscience. 2021 Jun;43(3):1201-1216. doi: 10.1007/s11357-020-00317-7. Epub 2021 Jan 7. PMID: 33410090; PMCID: PMC8190229.
Wei M, Brandhorst S, Shelehchi M, Mirzaei H, Cheng CW, Budniak J, Groshen S, Mack WJ, Guen E, Di Biase S, Cohen P, Morgan TE, Dorff T, Hong K, Michalsen A, Laviano A, Longo VD. Fasting-mimicking diet and markers/risk factors for aging, diabetes, cancer, and cardiovascular disease. Sci Transl Med. 2017 Feb 15;9(377):eaai8700. doi: 10.1126/scitranslmed.aai8700. PMID: 28202779; PMCID: PMC6816332.
Safdie FM, Dorff T, Quinn D, Fontana L, Wei M, Lee C, Cohen P, Longo VD. Fasting and cancer treatment in humans: A case series report. Aging (Albany NY). 2009 Dec 31;1(12):988-1007. doi: 10.18632/aging.100114. PMID: 20157582; PMCID: PMC2815756.
de Groot S, Lugtenberg RT, Cohen D, Welters MJP, Ehsan I, Vreeswijk MPG, Smit VTHBM, de Graaf H, Heijns JB, Portielje JEA, van de Wouw AJ, Imholz ALT, Kessels LW, Vrijaldenhoven S, Baars A, Kranenbarg EM, Carpentier MD, Putter H, van der Hoeven JJM, Nortier JWR, Longo VD, Pijl H, Kroep JR; Dutch Breast Cancer Research Group (BOOG). Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial. Nat Commun. 2020 Jun 23;11(1):3083. doi: 10.1038/s41467-020-16138-3. PMID: 32576828; PMCID: PMC7311547.
Nencioni A, Caffa I, Cortellino S, Longo VD. Fasting and cancer: molecular mechanisms and clinical application. Nat Rev Cancer. 2018 Nov;18(11):707-719. doi: 10.1038/s41568-018-0061-0. PMID: 30327499; PMCID: PMC6938162.
Cook AM, McDonnell AM, Lake RA, Nowak AK. Dexamethasone co-medication in cancer patients undergoing chemotherapy causes substantial immunomodulatory effects with implications for chemo-immunotherapy strategies. Oncoimmunology. 2015 Sep 16;5(3):e1066062. doi: 10.1080/2162402X.2015.1066062. PMID: 27141331; PMCID: PMC4839331.
Brandhorst S, Choi IY, Wei M, Cheng CW, Sedrakyan S, Navarrete G, Dubeau L, Yap LP, Park R, Vinciguerra M, Di Biase S, Mirzaei H, Mirisola MG, Childress P, Ji L, Groshen S, Penna F, Odetti P, Perin L, Conti PS, Ikeno Y, Kennedy BK, Cohen P, Morgan TE, Dorff TB, Longo VD. A Periodic Diet that Mimics Fasting Promotes Multi-System Regeneration, Enhanced Cognitive Performance, and Healthspan. Cell Metab. 2015 Jul 7;22(1):86-99. doi: 10.1016/j.cmet.2015.05.012. Epub 2015 Jun 18. PMID: 26094889; PMCID: PMC4509734.
